Terapia génica para la ALD
Authors: Virginie Bonnamain, Ph.D. and Stephan Kemp, Ph.D.
(Traducido por Nerea Montedeoca Vázquez (Biomedicine student))
En 2009, los Dres. Nathalie Cartier, Patrick Aubourg y colegas (Hospital Saint Vincent de Paul, París, Francia) informó del exitoso tratamiento de dos niños de 7 años con signos tempranos de adrenoleucodistrofia cerebral mediante terapia génica (Cartier et al. Science). Estos niños fueron candidatos para el trasplante alogénico de células madre hematopoyéticas (TCMH), pero no se encontraron donantes compatibles.
La terapia génica se basa en corregir las células de la médula ósea de los propios pacientes:
- Las células de la médula ósea fueron extraídas de los pacientes. Este proceso se denomina “aféresis”.
- En el laboratorio, una copia normal del gen de la adrenoleucodistrofia fue insertada en el interior de las células de la médula ósea mediante la utilización de un virus derivado del VIH.
- Los pacientes fueron sometidos a quimioterapia con el objetivo de eliminar su propia médula ósea para evitar que esta siguiese produciendo más células madre. Este procedimiento se denomina “condicionamiento”.
- A continuación, se les reinfundieron sus propias células genéticamente corregidas, las cuáles presentaban el gen normal para la adrenoleucodistrofia.
Vídeo explicativo sobre los conceptos básicos en el trasplante de células madre
https://www.youtube.com/watch?feature=player_embedded&v=7KzCc90z1Ts
Producido por bluebird bio, Inc.
Los dos pacientes fueron evaluados durante 24 y 30 meses. A lo largo de este período, el 15% de sus células sanguíneas mostraron expresión de la proteína de la adrenoleucodistrofia normal, mientras que antes de la terapia, no se detectó nada de proteína de la adrenoleucodistrofia normal en las células sanguíneas de los pacientes. Los VLCFA fueron reducidos alrededor de un 38% en el plasma de los pacientes.
Los escáneres cerebrales de RM y las pruebas cognitivas mostraron que la progresión de la enfermedad cerebral se detuvo pasados los 14-16 meses. Los pacientes permanecieron estables desde entonces. La lesión desmielinizante observada en la vía auditiva de uno de los pacientes fue revertida. La detención de la desmielinización cerebral progresiva en estos pacientes representa un resultado clínico comparable al obtenido mediante el TCMH.
Estudio Starbeam
El Estudio Starbeam (ALD-102, NCT01896102) es un estudio experimental en fase 2/3 sobre la terapia génica. Los objetivos consisten en determinar la seguridad y tolerabilidad del tratamiento de administración única mediante terapia génica conocido como “Lenti-D”, y en determinar si el tratamiento puede detener la progresión de la adrenoleucodistrofia cerebral. Desde el mes de abril de 2018, un total de 31 pacientes fueron incluidos en el estudio. De estos 31 pacientes, 29 fueron tratados con Lenti-D y la mediana en cuanto al seguimiento para todos los pacientes tratados fue de 34 meses (0,4 – 54 meses).
El principal criterio de valoración respecto de la eficacia para el estudio Starbeam es la ausencia de Discapacidades Funcionales Mayores (Major Functional Disabilities, MFDs) a los 24 meses tras el trasplante. Las MFDs se corresponden con discapacidades graves, las cuales se cree que puedan tener un gran impacto en la habilidad del paciente para valerse de forma independiente: pérdida de la capacidad para comunicarse, ceguera cortical, necesidad de ser alimentado mediante sondas, incontinencia total, dependencia de la silla de ruedas y pérdida completa del movimiento voluntario. El segundo criterio de valoración del estudio incluye la progresión de la enfermedad cerebral. Esto es evaluado mediante la intensificación de gadolinio en la RM cerebral (que es un indicador de neuroinflamación) y a través de la Puntuación de la Función Neurológica (Neurologic Function Score, NFS). La NFS se trata de un sistema de puntuación utilizado para evaluar la severidad de los déficits clínicos al calificar 15 síntomas en múltiples dominios). También se evaluó el perfil de seguridad de Lenti-D (efectos secundarios y análisis de la integración del gen en el genoma).
En octubre de 2017, los resultados de 17 pacientes tratados con Lenti-D, los cuales completaron un seguimiento durante 24 meses, fueron publicados (Eichler et al. 2017). En el momento del análisis de los datos para este grupo inicial de 17 pacientes, la mediana para el seguimiento era de 29,4 meses (21,6-42 meses).
- 15 (88%) de 17 pacientes sobrevivieron, con síntomas clínicos mínimos.
- 1 paciente murió debido a la progresión de la enfermedad durante el condicionamiento pre-trasplante.
- 1 paciente fue retirado del estudio y falleció debido a complicaciones derivadas de un trasplante alogénico posterior.
- De los 15 pacientes restantes, no se observaron indicios de la enfermedad del injerto contra el huésped (que se produce cuando las células trasplantadas “atacan” a las células del paciente).
- 14 de estos 15 pacientes obtuvieron una puntuación de entre 0 y 1 en la NFS, lo cual indica ausencia o síntomas clínicos mínimos.
- 12 de los 15 pacientes obtuvieron una puntuación estable en la escala Loes, lo cual indica ausencia de progresión de la lesión.
- La intensificación de gadolinio, que se encontraba presente desde el inicio en todos los pacientes, resultó hallarse ausente en los 15 pacientes alrededor del sexto mes postrasplante. En unos pocos pacientes, se produjo una reemergencia de la intensificación de gadolinio en varios momentos (incluyendo a 2 pacientes en el mes 24), pero esta potenciación resultó ser menos extensa que la intensificación de gadolinio que se hallaba presente desde el inicio.
Estos primeros resultados sugieren que el tratamiento de la adrenoleucodistrofia cerebral mediante terapia génica con Lenti-D es como mínimo igual de efectivo que el trasplante alogénico convencional. La ausencia de la enfermedad del injerto contra el huésped indican que posiblemente esta terapia sea más segura
Tras completar el estudio ALD-102 (aproximadamente 2 años), los pacientes fueron incluidos en un nuevo estudio (LTF-304, NCT02698579) para seguir a los pacientes durante 13 años más y evaluar así la seguridad y eficacia de la terapia a largo plazo.
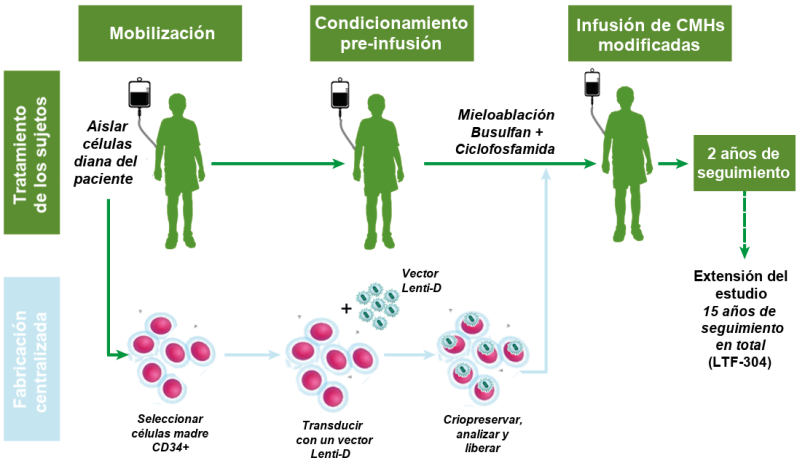 Figura: Resumen del protocolo para el tratamiento del estudio Starbeam. Imagen cedida por cortesía de bluebird bio.
Figura: Resumen del protocolo para el tratamiento del estudio Starbeam. Imagen cedida por cortesía de bluebird bio.
El patrocinador del estudio Starbeam, bluebird bio, es una compañía biotecnológica localizada en Cambridge, MA, EE.UU.
Last modified | 2019-03-14

